Kaltes Leuchten: Lumineszenz
Ganz allgemein gilt, dass Übergänge zwischen verschiedenen Zuständen von Molekülen, Atomen oder sonstigen Systemen immer in beiden Richtungen erfolgen können: Strahlung, die absorbiert werden kann, kann auch ausgesandt werden. Da die Moleküle aber ihre Anregungsenergie sehr leicht durch Wechselwirkung mit den Nachbarn wieder loswerden – in Wärmebewegung umwandeln – können, überwiegt die Absorption die Emission meist bei weitem und man sieht von der Emission nichts. Doch es gibt Ausnahmen: wenn im Dunkeln Energiezufuhr durch andere Mechanismen als durch Licht erfolgt.
Die Energiezufuhr kann durch Einstrahlung von ultraviolettem Licht erfolgen, durch Röntgenstrahlen, Beschuss mit Elektronenstrahlen, durch radioaktive Bestrahlung, durch elektrische Felder, auch durch chemische Reaktionen oder durch mechanische Beanspruchung.
Man kann auch das Leuchten der Atome, z.B. in Gasentladungen, zu den Lumineszenzerscheinungen rechnen. Wegen der grundlegenden Bedeutung für die Kenntnis des Atomaufbaues wurde diesem ein eigener Abschnitt gewidmet. Hier sollen größere Moleküle und Festkörper behandelt werden, die mit verhältnismäßig geringen Energien zum Leuchten gebracht werden können.
Wenn die durch Bestrahlung zugeführten Energien groß genug sind, leuchtet schließlich auch normales Wasser, wie die nebenstehende Aufnahme des Kerns eines Forschungs-Kernreaktors zeigt (TRIGA Mark 3 mit Wasser als Neutronen-Moderator und zur Abschirmung der Strahlung nach oben). |
 |
BiolumineszenzBiolumineszenz ist in der Natur eher selten zu beobachten – bei Glühwürmchen, Mikroorganismen im Meer (Meeresleuchten) und verschiedenen Tieren in der Tiefsee.
Rechts: Das Glühwürmchen Lampyris noctiluca. |
 |
Reibung
Lumineszenz bei mechanischer Beanspruchung, insbesondere Reibung, bezeichnet man als Tribolumineszenz. Die Energie, die dabei auf die Körper übertragen wird, ist sehr hoch im Vergleich zu typischen atomaren oder molekularen Anregungsenergien. Es werden chemische Bindungen aufgebrochen und Ladungen getrennt und entsprechend vielfältig sind dann die möglichen Vorgänge, die zur Emission von Licht führen können. Praktische Nutzanwendungen zeichnen sich kaum ab, und daher besteht an der Erforschung wenig Interesse.
Eine leicht verfügbare Substanz, die Tribolumineszenz zeigt, ist Zucker. Reibt man bei Dunkelheit zwei Stücke Würfelzucker aneinander, so kann man das Leuchten beobachten, wenn die Augen gut an die Dunkelheit gewöhnt sind (es muss stockfinster sein). Allerdings nimmt man keine Farbe wahr, das Leuchten erscheint weiß.
Die Emission erfolgt überwiegend im Blauen und Ultravioletten. Das von geriebenem Zucker emittierte Licht wurde von
Zink et al. (J. Phys. Chem., 1976, 80 (3), pp 248–249) spektroskopisch untersucht und als Emissionsspektrum von Stickstoffmolekülen N
2 identifiziert.
Wurde der Zucker durch Erhitzen in Vakuum entgast, so zeigte er in stickstofffreier Umgebung keine Tribolumineszenz mehr.
Sehr viel höher als bei Zucker ist die Lichtausbeute bei Quarz, der in Form von Kieselsteinen ebenfalls leicht zugänglich ist. Die orangefarbenen Lichtblitze, die im Dunkeln gut zu beobachten sind, wenn man Kieselsteine mit Druck aneinander reibt, erinnern an Funken (Bilder unten). Dass es keine Funken sind, kann man daran erkennen, dass die Lichtblitze unter Wasser auch entstehen.


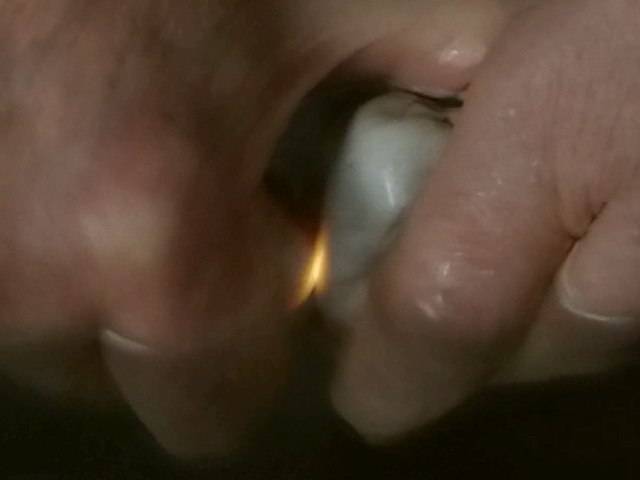
Links: Bei Kieselsteinen ist Tribolumineszenz schon bei gedämpftem Tageslicht zu sehen.
Mitte: Im Fall von transparenten Kieseln verteilt sich das Licht über den ganzen Stein.
Rechts: Unter Wasser geht es genau so gut.
Laut
Chapman & Walton (J. Appl. Phys. 54, 5961 (1983)) ist das Emissionsspektrum von Quarz, wenn er gesägt wird, dem eines Schwarzen Körpers von 2800 K ähnlich.
Anregung durch Strahlung
Man spricht von Fluoreszenz, wenn die Anregungen sehr rasch zerfallen, von Phosphoreszenz, wenn diese Zustände längere Lebensdauern haben (Sekunden, Minuten oder längeres Nachleuchten).
„Schwarzlicht“
Ultraviolettstrahler, die (laut Herstellerangaben) Licht von 366 nm Wellenlänge aussenden, sogenannte „Schwarzlicht“-Lampen oder Röhren, werden in Discotheken oder bei Parties zur effektvollen Beleuchtung eingesetzt und lassen Zähne, Hemden und manche anderen Gegenstände leuchten. Die Beispielfotos weiter unten wurden unter einer Schwarzlichtröhre aufgenommen.
Beispiele
Chlorophyll
Chlorophyll fluoresziert – aber hält man ein grünes Blatt unter die UV-Lampe, so sieht man davon (meist) nur wenig, „da die Anregungsenergie fast vollständig über das Photosystem verbraucht wird“ schreibt Dieter Weiß und gibt den Hinweis auf die Gelbflechte Xanthoria parietina, bei der man das doch sehen kann.


Mit Gelbflechten bewachsene dürre Zweige eines Nussbaums. Das in den Algen der Flechten enthaltene Chlorophyll fluoresziert rot; die bläulich-weiße Fluoreszenz der Rinde dürfte von Bakterien oder Pilzen stammen.
Rosskastanie
|
Zweig einer Rosskastanie im Wasser, unter langwelliger UV-Strahlung („Schwarzlicht“). Der Saft von
Rosskastanien enthält Aesculin, eine blau fluoreszierende Substanz, die Strahlung aus dem nahen Ultraviolett in kurzwelliges Licht umwandelt (wie die optischen Aufheller in vielen Waschmitteln).
| |  |
Bananen
Dass reife Bananen blau fluoreszieren ist überraschend:

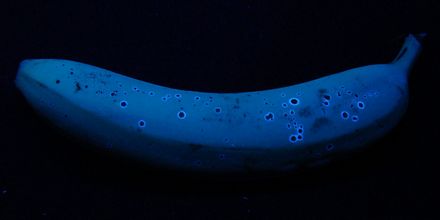
Eine Banane, links bei Tageslicht, rechts bei UV-Beleuchtung.
Ursache ist (laut
Bernhard Kräutler et al.: Die blaue Lumineszenz reifender Bananen - Angewandte Chemie Vol. 120, No. 46 (2008) S. 9087;
"Fluorescent chlorophyll catabolites ...") ein Abbauprodukt des Chlorophylls, das nur langsam zerfällt.
Schöllkraut
Mineralien
Bei der Besprechung des Rubins wurde auch schon kurz auf dessen Fluoreszenz eingegangen. Die Übergänge zwischen verschiedenen Energiezuständen, die unter Absorption von Licht vonstatten gehen, können auch in umgekehrter Richtung ablaufen, wobei Lichtquanten emittiert werden. Wie beim Rubin schon gesagt, kann die Anregungsenergie aber auch durch konkurrierende Prozesse abgegeben werden – als unsichtbare Infrarotstrahlung oder durch Anregung von Gitterschwingungen (Wärmebewegung). Unter normalen Bedingungen ist daher von der im Prinzip möglichen Lichtemission nichts zu sehen.
Anwendungen
Fluoreszierende und auch phosphoreszierende Stoffe werden in der Technik vielfach verwendet. Leuchtstoffröhren und -Lampen (Energiesparlampen) enthalten Quecksilberdampf, der bei der stattfindenden Gasentladung neben sichtbarem Licht Ultraviolettstrahlung emittiert. Die fluoreszierende Beschichtung auf der Innenseite wandelt diese in sichtbares Licht um. Je nach der Art der Beschichtung lassen sich die verschiedensten Farben erzielen, wie sie in der Lichtreklame eingesetzt werden. Kathodenstrahlröhren (Fernsehbildschirme und Computermonitore) sind Beispiele für Fluoreszenz in kräftigen Farben. Auch für die modernen Flachbildschirme werden Leuchtstoffe verwendet. Information über die verschiedenen Leuchtstoffe findet man auf den Internetseiten der Hersteller, z.B. hier.
Bei der Besprechung der Farbe von Mineralien haben wir gesehen, dass Substanzen, die im reinen Zustand farblos sind, durch „Verunreinigungen“ farbig werden. Durch Verunreinigung mit Chrom wird der farblose Korund zum Rubin, Beryll zum Smaragd. Durch Fehlstellen oder Verunreinigungen entstehen zusätzliche Energieniveaus innerhalb der Bänderstruktur des Minerals, die die Absorption von Licht ermöglichen. Analog können durch Fremdatome oder Fehlstellen in Substanzen, die im reinen Zustand nicht fluoreszieren, Energieniveaus geschaffen werden, die beim Übergang von den hochangeregten Zuständen in den Grundzustand als Zwischenstufen fungieren und die Emission von Licht ermöglichen. Das gezielte Hinzufügen von Fremdatomen nennt man Dotieren.
Beispiel: Zinksulfid, ZnS, kommt als Mineral in zwei Modifikationen vor: kubische Zinkblende (Sphalerit) und hexagonaler Wurtzit (seltener). Zinksulfid wird als weißes Pigment verwendet, meist in einer Mischung mit Bariumsulfat. Dotiert mit Aluminium, Kupfer, Silber oder anderen Metallen zeigt es Lumineszenz. ZnS:Ag wird in Kathodenstrahlröhren als blauer Leuchtstoff verwendet (neben anderen Substanzen). Dotierung mit Mangan (ZnS:Mn) ergibt orangerote Fluoreszenz. Dotierung mit Kupfer ergibt grünliche Phosphoreszenz mit langer Nachleuchtdauer. Grünlich leuchtendes Zinksulfid wurde schon früh für Schirme zum Nachweis von Röntgenstrahlen und für Leuchtfarben etc. verwendet.
 | |
Graue Fläche auf einem Computerbildschirm (Kathodenstrahlröhre), durch eine starke Lupe fotografiert. Die einzelnen leuchtenden „Punkte“ sind so klein, dass sie bei normaler Betrachtung nicht mehr unterschieden werden können. Es sind nur rote, grüne und blaue Leuchtpunkte vorhanden, mit denen alle auf dem Schirm darstellbaren Farben erzeugt werden. Der rote Leuchtstoff könnte Y2O3:Eu sein (mit Europium dotiertes Yttriumoxid), für den grünen kommt ZnS:Cu,Au,Al in Frage oder Zn2SiO4:Mn und für den blauen, wie schon gesagt, ZnS:Ag (mit Silber dotiertes Zinksulfid).
|
Tageslicht-Leuchtfarben, die z.B. für Textmarker verwendet werden, erscheinen besonders hell, weil sie kurzwelliges Licht absorbieren und die Energie durch mittel- oder langwelliges Licht wieder abgeben.
 | Die mit einem Textmarker gefärbte Stelle ist heller als das umgebende weiße Papier! Der Farbstoff (Fluorescein oder Uranin = Natriumsalz des Flouresceins) absorbiert kurzwelliges Licht (Absorptionsmaximum bei 494 nm), gibt aber einen großen Teil der absorbierten Energie als grünes Fluoreszenzlicht (Maximum bei 521 nm) wieder ab (Daten: 1, 2). Zusammen mit dem langwelligen remittierten Licht ergibt das die helle grünlichgelbe Farbe.
|
Weitere Anwendungen der Fluoreszenz in Chemie, Medizin, Mineralogie, Geologie, Kriminalistik etc. sollen hier nicht besprochen werden. Ein letztes Beispiel noch: die Verwendung fluoreszierender Druckfarben für Banknoten, um Fälschungen zu erschweren und automatisches Erkennen zu erleichtern:
Ein Link
Einen guten Überblick über die verschiedenen Arten von Lumineszenz gibt Dieter Weiß auf seiner Seite
„Lumineszenz“.
Zurück zur Übersicht: Wie kommt Farbe zustande?





